¡BIENVENIDOS!
QUÍMICA
NOVIEMBRE 03 DE 2014
SALES: TIPOS Y NOMENCLATURA
Una sal es el producto de la reacción entre un ácido y una base: en esta reacción también se produce agua: en términos muy generales, este tipo de reacción se puede escribir como :
| BASE + ÁCIDO |
→
|
SAL + AGUA
|
EJEMPLO;
Na
|
| Cl | → | NaCl + | H2O | |
Se observa que el ácido dona un H+ a cada OH- de la base para formar H2O y segundo que la combinación eléctricamente neutra del ion positivo Na+, de la base y el ion negativo del ácido, Cl-, es lo que constituye la sal. Es importante tener en cuenta que el elemento metálico, Na+, se escribe primero y luego el no metálico, Cl-.
También se considera una sal a el compuesto resultante de sustituir total o parcialmente los hidrógenos ( H+) de un ácido por metales: las sales se dividen en sales neutras, sales haloideas o haluros, oxisales , sales ácidas y sales básicas.
SALES NEUTRAS
SALES NEUTRAS
Resultan de la sustitución total de los hidrógenos ( H+) por un metal. El nombre que recibe la sal se deriva del ácido del cual procede; las terminaciones cambian según la siguiente tabla ;
| NOMBRE DEL ÁCIDO | NOMBRE DE LA SAL |
| __________________hídrico | __________________uro |
| hipo_______________oso | hipo________________ito |
| __________________ oso | ___________________ito |
| __________________ ico | ___________________ato |
| per________________ico | per________________ ato |
se da primero el nombre del ion negativo seguido del nombre del ion positivo
| FeCl2 = cloruro ferroso | FeCl3 = cloruro férrico |
Sin embargo para este caso el esquema de nomenclatura de la IUPAC, que se basa en un sistema ideado por A Stock, indica el estado de oxidación del elemento mediante un numero romano en paréntesis a continuación del nombre del elemento así;
Ejemplo:
| FeCl2 = cloruro de hierro ( II) | FeCl3 = cloruro de hierro (III) |
Si el elemento metálico forma un ion de un solo estado de oxidación no se usa numero romano ejemplo;
Ejemplo:
| LiI = Yoduro de Litio |
SALES HALOIDEAS O HALUROS.
Se forman por la combinación de un hidrácido con una base. En la formula se escribe primero el metal y luego el no metal (con la menor valencia) y se intercambian las valencias). Los haluros se nombran cambiando la terminación hidrico del ácido por uro y con los sufijososo e ico, según la valencia del metal.
EJEMPLO;
| Cu(OH) + HCl | → |
CuCl
| + H2O | |
ácido clorhídrico
|
cloruro cuproso
| |||
| 2Fe(OH)3 + H2S | → |
Fe2S 3
| + 6H2O | |
ácido sulfhídrico
|
sulfuro férrico
| |||
Si un par de no metales forman más de un compuesto binario, como es el caso más frecuente, para designar el número de átomos de cada elemento En este el estado de oxidación del elemento se usan los prefijos griegos: bi: dos, tri: tres, tetra: cuatro, penta: cinco, hexa: seis, etc, antecediendo el nombre del elemento, por ejemplo;
| PS3 = trisulfuro de fósforo | PS5 = pentasulfuro de fósforo |
OXISALES.
Se forman por la combinación de un oxácido con una base. En la formula se escribe primero el metal, luego el no metal y el oxigeno. Al metal se le coloca como subíndice la valencia del radical (parte del oxácido sin el hidrógeno) que depende del numero de hidrógenos del ácido. Las oxisales se nombran cambiando la terminación oso del ácido porito e ico por ato
Ejemplo;
| KOH + HClO | → |
KClO
| + H2O | |
ácido hipocloroso
|
hipoclorito de sodio
| |||
| Al(OH)3 + HNO3 | → |
Al(NO3)3
| + H2O | |
ácido nítrico
|
nitrato de aluminio
| |||
SALES ÁCIDAS.
Resultan de la sustitución parcial de los hidrógenos del ácido por el metal. en la formula se escribe primero el metal, luego el hidrógeno y después el radical.
EJEMPLO:
| NaOH + H2CO3 | → |
NaHCO3
| + H2O | |
ácido carbónico
|
carbonato ácido de sodio ( Bicarbonato de sodio)
| |||
SALES BÁSICAS.
Resultan de la sustitución parcial de los hidróxidos (OH) de las bases por no metales. En la formula se escribe primero el metal, luego el OH y finalmente el radical.
EJEMPLO:
CuOHNO3 = nitrato básico de cobre (II)
Se aplican las reglas generales para nombra oxisales, pero se coloca la palabra básica entre nombre del radical y el metal
EJEMPLO:
| Cu(OH)2 + HNO3 | → |
CuOHNO3
| + H2O | |
ácido nitrico
|
nitrato básico de cobre (II)
| |||
SALES DOBLES.
Se obtienen sustituyendo los hidrógenos de ácido por mas de un metal. en la formula se escribe los dos metales en orden de electropositividad y luego el radical. Se da el nombre del radical seguido de los nombres de los metales respectivos.
EJEMPLO:
Al(OH)3 + KOH + H2SO4
| → |
KAl(SO4)
|
+ H2O
| |
ácidosulfurico
|
sulfato de aluminio y potasio ( alumbre)
| |||
OCTUBRE 28 DE 2014
ÁCIDOS
Se denominan ácidos a las sustancias que se caracterizan por.
- Ceder protones o iones hidrógeno( H+) en medio acuoso.
- Enrojecer el papel tornasol azul.
- Permanecer incolora la fenolftaleína,(incolora en medio neutro) en un medio ácido.
- Presentar sabor agrio, picante( los ácidos no se deben saborear por ser muchos de ellos tóxicos).
Hidrácidos y oxácidos.
HIDRÁCIDOS.
Hidrácido = hidrógeno + no metal
Son ácidos constituidos por la combinación del hidrógeno con un elemento no metal. Los hidrácidos se nombran con la palabra genérica ácido, raíz del no metal y el sufijo hídrico.
Algunas combinaciones de hidrógeno con no metal no se consideran hidrácidos por no presentar las propiedades químicas que caracterizan a los ácidos, algunos de ellos son:
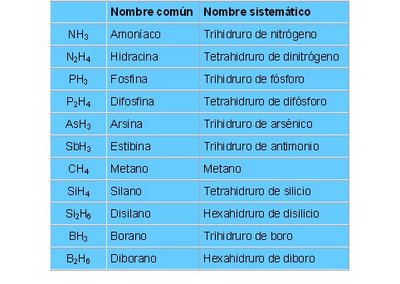
OXÁCIDOS
Oxácido = óxido ácido + agua
Estos ácidos, además de ser combinaciones del hidrógeno con elementos no metales, contienen en su molécula oxígeno, pues resultan de la combinación de óxidos ácidos con el agua.
SEPTIEMBRE 30 DE 2014
HIDRÓXIDOS O BASES: Formados por la unión de un óxido básico y el agua
Son compuestos formados por la unión de un metal con el ion hidroxilo: OH-, que actúa en su conjunto con una valencia igual a 1.
| EJEMPLO | NOMBRES | ||
| NaOH | Hidróxido de sodio | Hidróxido de sodio | Hidróxido de sodio |
| Ca(OH)2 | Hidróxido de calcio | Hidróxido de calcio | Dihidróxido de calcio |
| Fe(OH)2 | Hidróxido ferroso | Hidróxido de hierro (II) | Dihidróxido de hierro |
| Fe(OH)3 | Hidróxido férrico | Hidróxido de hierro (III) | Trihidróxido de hierro |
| Cd(OH)2 | Hidróxido de cadmio | Hidróxido de cadmio | Dihidróxido de cadmio |
| NH4OH | Hidróxido de amonio | Hidróxido de amonio | Hidróxido de amonio |
El hidróxido de amonio NH4OH está formado por la combinación del catión amonio NH4+ y el anión hidroxilo OH-
EJERCICIOS
| |
| Formular los siguientes compuestos: | Nombrar los siguientes compuestos: |
| a) Hidróxido sódico | a) AuOH |
| b) Hidróxido de hierro (II) | b) Ca(OH)2 |
| c) Trihidróxido de aluminio | c) Hg(OH)2 |
| d) Hidróxido ferroso | d) Pt(OH)4 |
| e) Hidróxido aúrico | e) KOH |
BIOLOGÍA
SEPTIEMBRE 23 DE 2014
FENÓMENOS ELÉCTRICOS
Probablemente hayas visto un rayo como el de la fotografía. También habrás advertido las interferencias en la radio y en la televisión durante una tormenta.
- ¿Qué relación crees que exista entre los rayos, las nubes y la tierra?
- ¿Qué otros fenómenos similares ocurren en la naturaleza?
- ¿Cómo se han obtenido las explicaciones científicas de estos fenómenos?
En este cuarto periodo realizaremos algunas experiencias que nos ayudarán a entender el porqué de los adelantos tecnológicos que de allí se han derivado.
LABORATORIO :OBSERVEMOS LA ATRACCIÓN Y REPULSIÓN ENTRE OBJETOS
Seguramente te has divertido atrayendo pedacitos de papel con un peine.Quizá también te has preguntado sobre cuál es la causa de este fenómeno y otros similares.
A continuación realizaremos algunos experimentos, que nos permitirán tener mayor claridad sobre estas inquietudes.
MATERIALES: Tijeras, hojas de papel periódico, globos de caucho, trocitos de papel, dos barras o esferos plásticos, cepillo plástico para cabello, trozo de felpa, retazo de paño, retazo de seda.
- Corta una tira de papel periódico de 3 cm de ancho por 60 cm de largo, doblala por la mitad; cógela por el doblez, con una mano. Coloca los extremos libres entre tres dedos de la otra mano y frota varias veces las tiras de papel, hacia el extremo libre. Registra en tu cuaderno los cambios que observes.
- Infla uno de los globos de caucho y frótelo, por uno de sus lados, con el retazo de paño o contra el cabello seco. Acerca el globo por el lado frotado, a una pared.Toma nota en tu cuaderno de lo que suceda.
- Infla dos globos y cuelgalos, de tal manera que apenas se toquen. Luego, frota con la felpa los lados por donde se tocan ambos globos y suéltalos. Registra tus observaciones en el cuaderno.
- Peínate con un cepillo. Acércalo a un grupo de trocitos de papel . Registra en tu cuaderno lo que observas. Detalla el comportamiento de los trocitos, para no omitir hechos importantes.
- Peínate en la oscuridad con el cepillo frente a un espejo. Toma atenta nota de lo que observes y escuches.
- Con un hilo de seda, amarra del centro una de las barras plásticas y cuelgala de tal forma que quede horizontal, Frota uno de los extremos de la barra colgada con el retazo de paño; acércala al extremo frotado de la primera barra. Registra lo que observes en este paso.
- Frota nuevamente con el paño un extremo de la barra suspendida. Ahora frota la otra barra plástica con la felpa y acercarla a la primera.
- Repite el paso anterior, pero ahora frota la barra plástica libre con el retazo de seda.
- Vuelve a frotar con el paño un extremo de la barra plástica suspendida. Frota un tubo de ensayo con el pedazo de felpa y acércalo a la barra suspendida.
- Repite el procedimiento anterior, pero ahora frota el tubo de ensayo, primero con la seda y luego con el paño.
- ¿Qué sucedió con las tiras de papel al frotarlas?
- ¿Cómo explicas la interacción entre el globo frotado y la pared?
- ¿Cómo explicas la interacción entre los globos luego de haber sido frotados?
- Discute con los compañeros de grupo del laboratorio lo sucedido al acercar el cepillo al grupo de papeles. Argumenta la razón que creas apropiada y explica este comportamiento.
- Discute con tus compañeros las posibles causas de lo visto y escuchado al peinarte en la oscuridad.
- ¿Qué sucedió al acercar a la barra plástica suspendida la otra barra plástica, luego de haberlas frotado con retazos del mismo material?
- ¿Que ocurrió cuando a la barra plástica suspendida y frotada con paño se le acerco el tubo de vidrio frotado con la felpa?
- ¿Qué sucedió al frotar la barra plástica libre con materiales diferentes?
- ¿Qué diferencias hallaron al frotar el tubo de ensayo con materiales distintos y, luego, acercarlo a la barra suspendida frotada con paño?.
1.2 Electrización y cargas
En los experimentos anteriores has podido observar que los cuerpos se pueden electrizar de tres maneras: por frotamiento, por contacto y por inducción.
A finales del siglo XIX se descubrieron unas partículas que tenían carga eléctrica negativa y que se llamaron electrones. Este descubrimiento hizo pensar a los científicos que los átomos no son indivisibles. Por lo tanto, debían tener una parte cargada positivamente ya que en su conjunto son neutros.
Diversas experiencias permitieron descubrir que esa parte cargada positivamente es un denso núcleo alrededor del cual giran los electrones. Este núcleo, a su vez, está formado por dos tipos de partículas unidas firmemente, los protones y los neutrones. Los protones tienen carga positiva y los neutrones no tienen carga.
Las cargas del protón (positiva) y la del electrón (negativa) son iguales pero de signo contrario.
La existencia de los electrones permite explicar las tres formas de electrización que has visto.
Electrización por frotamiento
Al frotarse dos cuerpos se produce el paso de electrones de la superficie de uno a la del otro. El cuerpo que pierde electrones pierde carga negativa y queda cargado positivamente. El cuerpo que gana electrones queda cargado negativamente.
Electrización por frotamiento
Es el resultado de la transferencia de electrones entre dos cuerpos:
- Un cuerpo cargado positivamente posee defecto de electrones.
- Un cuerpo cargado negativamente posee exceso de electrones.
Si frotas un bolígrafo con la manga de tu jersey de lana pasan al bolígrafo 100 000 electrones. ¿Cómo queda la manga de tu jersey?
Cargada positivamente. Los electrones que pasan al jersey los pierde la manga, que queda con un exceso de carga positiva igual a la negativa de los 100 000 electrones.
Electrización por contacto
Al poner en contacto un cuerpo descargado (la bolita del péndulo) y un cuerpo cargado (la varilla frotada), los electrones pasan de un cuerpo a otro:
- Si la varilla está cargada negativamente (plástico) algunos electrones pasan de la varilla a la bolita del péndulo que queda cargado negativamente.
- Si la varilla está cargada positivamente (vidrio) algunos electrones pasan de la bolita a la varilla, quedando el péndulo cargado positivamente.
Electrización por contacto
Es el resultado de la redistribución de los electrones entre los dos cuerpos.
Electrización por inducción
Cuando se aproxima la varilla frotada (cargada) al extremo superior del electroscopio (o a la bola descargada), los electrones se acercan o se alejan de la zona por la que se aproxima la varilla según que la carga de ésta sea positiva o negativa. Los electrones son atraídos por la varilla positiva y repelidos por la varilla negativa.
El electroscopio sigue siendo en su conjunto neutro, pero la zona próxima a la varilla positiva tiene un exceso de electrones y la zona más alejada de la varilla presenta un defecto de electrones. Así mismo la zona próxima a la varilla negativa tiene un defecto de electrones y la zona más alejada de la varilla presenta un exceso de electrones. Puedes cargar el electroscopio como se indica en las figuras siguientes.
Electrización por inducción
Un cuerpo es eléctricamente neutro cuando el número de cargas positivas que posee es igual al de cargas negativas.
La electrización por inducción es el resultado del movimiento de los electrones del cuerpo neutro, atraídos o repelidos según sea la carga (positiva o negativa) del cuerpo cargado que se le aproxima.
En los procesos de electrización la carga eléctrica total permanece constante (la carga eléctrica se conserva). Los electrones pasan de unos cuerpos a otros o se desplazan en uno, pero la carga total es la misma.
En la simulación, mueve el globo sobre el jersey y observa lo que sucede.
Al frotar un globo con una prenda de lana ésta pierde electrones que pasan al globo. Éste queda cargado negativamente y el jersey de lana positivamente (electrización por frotamiento).
Una vez cargado el globo acércalo a la pared y observa como las cargas positivas y las negativas, inicialmente juntas (la pared es neutra), se separan (electrización por inducción). Las cargas positivas se situan en la superficie de la pared y atraen al globo cargado negativamente, que se pega a la pared.
Elige la opción "Two Balloons" y carga los dos globos. Al intentar acercarlos se repelen, al mismo tiempo que son atraídos por el jersey que ha quedado cargado positivamente
SEPTIEMBRE 2 DE 2014
AGOSTO 26 DE 2014
A continuación se presenta la nomenclatura de algunos óxidos básicos que resultan de la combinación del oxigeno con un metal (nomenclatura sistemática, stock o internacional y la tradicional o común).
| ÓXIDOS BÁSICOS (METAL) | ||
| Observemos que los subindices aparecen intercambiando (las valencias del metal y del oxígeno); si es posible se simplifican. En la primera columna escribiremos la fórmula, en la segunda, la nomenclatura sistemática (primero) y de Stock (después) y en la tercera, la tradicional. El prefijo mono puede omitirse. | ||
| FORMULA |
SISTEMÁTICA/STOCK
|
TRADICIONAL
|
| BaO | (mon)óxido de bario | óxido de bario |
| óxido de bario | ||
| Na2O | (mon)óxido de disodio | óxido de sodio |
| óxido de sodio | ||
| Al2O3 | trióxido de dialuminio | óxido de aluminio |
| óxido de aluminio | ||
| CoO | (mon)óxido de cobalto | óxido cobaltoso |
| óxido de cobalto (II) | ||
| CuO | (mon)óxido de cobre | óxido cúprico |
| óxido de cobre (II) | ||
| Cu2O | óxido de dicobre | óxido cuproso |
| óxido de cobre (I) | ||
| FeO | óxido de hierro | óxido ferroso |
| óxido de hierro (II) | ||
| Fe2O3 | trióxido de dihierro | óxido férrico |
| óxido de hierro (III) | ||
| Rb2O | óxido de dirrubidio | óxido de rubidio |
| óxido de rubidio | ||
| MgO | óxido de magnesio | óxido de magnesio |
| óxido de magnesio | ||
| PbO | óxido de plomo | óxido plumboso |
| óxido de plomo (II) | ||
| K2O | óxido de dipotasio | óxido de potasio |
| óxido de potasio | ||
| SnO | óxido de estaño | óxido estannoso |
| óxido de estaño (II) | ||
| SnO2 | dióxido de estaño | óxido estánnico |
| óxido de estaño (IV) | ||
| MnO | óxido de manganeso | óxido manganoso |
| óxido de manganeso (II) | ||
| Mn2O3 | trióxido de dimanganeso | óxido mangánico |
| óxido de manganeso (III) | ||
| NO | (mon)óxido de nitrógeno | óxido nitroso |
| óxido de nitrógeno (II) | ||
| NO2 | dióxido de nitrógeno | bióxido de nitrógeno |
| óxido de nitrógeno (IV) | ||
| BeO | óxido de berilio | óxido de berilio |
| óxido de berilio | ||
| Au2O3 | trióxido de dioro | óxido áurico |
| óxido de oro (III) | ||
| CaO | óxido de calcio | óxido de calcio |
| óxido de calcio | ||
| ZnO | óxido de cinc | óxido de cinc |
| óxido de cinc | ||
| CrO | (mon)óxido de cromo | óxido cromoso |
| óxido de cromo (II) | ||
| Cr2O3 | trióxido de dicromo | óxido crómico |
| óxido de cromo (III) | ||
| HgO | óxido de mercurio | óxido mercúrico |
| óxido de mercurio (II) | ||
| Hg2O | óxido de dimercurio | óxido mercurioso |
| óxido de mercurio (I) | ||
| PtO2 | dióxido de platino | óxido platínico |
| óxido de platino (IV) | ||
| Co2O3 | trióxido de dicobalto | óxido cobáltico |
| óxido de cobalto (III) | ||
| CO | monóxido de carbono | óxido carbónico |
| óxido de carbono (II) | ||
.











No hay comentarios:
Publicar un comentario